pg电子官网app下载网页版
【转自BioArt】越来越多表观、代谢相关的酶在不同的生命过程中呈现了非经典的兼职功能(Moonlighting functions)。RNA聚合酶的经典功能是依据DNA模板生成RNA,但是RNA聚合酶除了RNA生成之外的非经典功能却知之甚少。RNA聚合酶亚基的变异或者异常表达和不同组织的疾病密切相关,表明亚基自身的功能重要。先前的常规干扰手段如RNA干扰、元宝网官网登录敲除等需要较长时间,会产生大量二级效应,因而很难确定RNA聚合酶的非经典功能。
2023年3月15日,北京大学pg电子官网app下载彩票、北大-清华生命科学联合中心季雄课题组在Molecular Cell 杂志在线发表了题为 RNA Pol II preferentially regulates ribosomal protein expression by trapping disassociated subunits 的研究论文。该研究报道了RNA聚合酶亚基RPB3能够通过CBC-PCF11和小延伸复合物特异性调控核糖体蛋白元宝网官网登录的3’末端加工的非经典兼职功能机制,表明RNA聚合酶可以通过游离组分实现单功能酶到多功能酶的转变,把不同的活性限制在全酶附近增加了元宝网官网登录表达效率,并且实现特异性调控。同时该研究提出的SDDS系统为其它复合体亚基的非经典兼职功能研究提供了新工具。该工作被Molecular Cell 杂志在同期“Meet the authors”专栏作为研究亮点采访报道。

研究者首先利用染色质组分的分子筛实验在多种哺乳动物细胞系中均检测到独立于Pol II全酶的RPB3,称为disassociated RPB3 (dRPB3)。随后研究者设计了一种巧妙的策略-Specific Degradation of Dissociated Subunits,简称SDDS系统,该系统在RPB3 degron细胞的基础上,将偶联linker区的RPB3整合到内源RPB1的终止密码子前,得到纯合的RPB1-linker-RPB3融合蛋白表达细胞,称为dRPB3 degron细胞。理论上RPB3 degron细胞在化学分子吲哚乙酸(IAA)处理后可降解细胞内全部RPB3,而dRPB3 degron细胞在IAA处理后,全酶中的RPB3可被RPB1偶联的RPB3替代,维持了全酶的完整性,但会导致游离于全酶之外的RPB3被降解。因此通过比较dRPB3 degron细胞IAA处理前后的功能差异,即可阐释游离RPB3的功能。
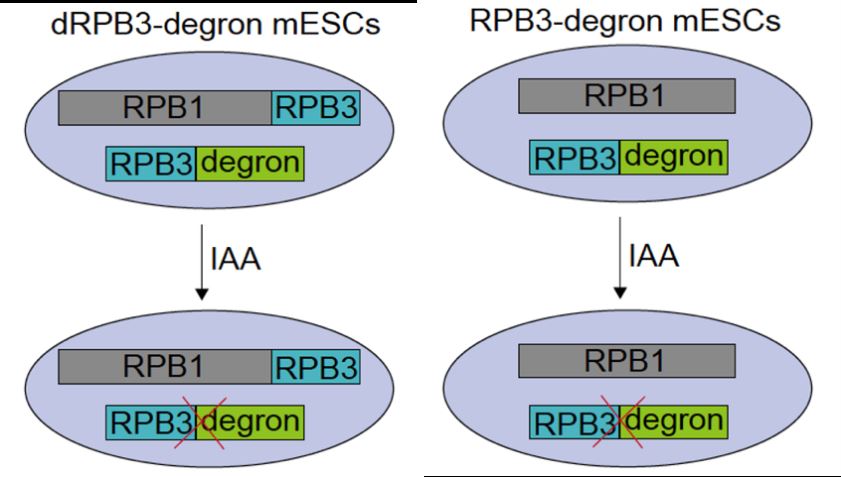
图1. 游离RPB3(dRPB3)蛋白瞬时降解系统(SDDS)和RPB3蛋白瞬时降解系统建立
为了确认SDDS系统是否正常工作,研究者们通过RNA-seq、ChIP-seq、ChIP-Western、IF等实验对dRPB3 degron细胞进行了多个层面的质量控制,结果显示在RPB1末端偶联linker-RPB3不影响Pol II全酶的功能,也不干扰对RPB1的蛋白互作和定位。RPB3 degron细胞在IAA处理后可导致RPB1与多种小亚基相互作用的减少,然而dRPB3 degron细胞在IAA处理后并不影响RPB1与小亚基的相互作用。同时搭配AlphaFold2的蛋白结构预测,研究者认为dRPB3 degron细胞在IAA处理后,正如所设想的方式,仅造成游离RPB3降解,全酶中的RPB3可被偶联于RPB1末端的RPB3所代偿,维持了全酶功能的完整性。
随后,研究者们开展了dRPB3、RPB3降解前后的RNA-seq、ChAR-seq实验分析,结果显示不同于RPB3降解后造成的部分元宝网官网登录表达下调,dRPB3的降解对元宝网官网登录表达幅度影响较小,但却可导致特异的RNA剪接错误和3’末端加工障碍,表明dRPB3参与转录后调控。更有意思的是RNA 3’末端加工障碍特异性富集在核糖体蛋白元宝网官网登录。代表新生转录组的TT-seq实验进一步证明dRPB3参与调控核糖体蛋白元宝网官网登录的RNA 3’末端加工。

图2. dRPB3瞬时降解造成特异性核糖体蛋白的3’末端加工障碍
为了探究dRPB3调控RNA 3’末端加工的分子机制,研究者根据ChIP-MS、ChIP-Western、ChIP-qPCR等实验,发现游离RPB3可招募NCBP1、PCIF1、PCF11到Pol II 全酶附近,帮助维持各蛋白与Pol II全酶的互作,确保了转录的正常终止。随后研究者通过蛋白结构域基序分析,证明只保留RPB3前137个氨基酸的显性负调控突变体—RPB3-N137,在不能组装进Pol II全酶的前提下,依然能够与NCBP1互作,而表达该突变体同样造成内源核糖体蛋白元宝网官网登录的3’末端加工障碍。更进一步地,研究者利用双荧光素酶报告系统检测了游离RPB3对核糖体相关蛋白元宝网官网登录的转录终止调控作用,同样发现游离RPB3对元宝网官网登录转录终止的调控具有核糖体蛋白元宝网官网登录特异性,并且依赖于PCF11及其识别的转录终止基序。这些结果证实了游离RPB3对于核糖体元宝网官网登录转录终止的调控作用。
为了探究游离RPB3调控核糖体元宝网官网登录特异性的机制,研究者通过机器学习算法,发现dRPB3特异性影响3’末端加工的元宝网官网登录可以被LEC (Little Elongation Complex) 小延伸复合物组分ELL2、AFF4在这些元宝网官网登录启动子区域的DNA结合水平解释,而这两者参与形成的小延伸复合物,先前被报道调控元宝网官网登录的3’末端加工。通过Co-IP和体外pulldown实验,研究者认为游离RPB3同样招募ELL2,协助LEC复合物调控Pol II 全酶。另外研究者们在体外相分离实验中发现Pol II CTD形成的液滴可招募游离RPB3在其液滴外表面。因此研究者提出: 高水平的核糖体相关蛋白元宝网官网登录的转录导致Pol II转录工厂中的Pol II CTD捕获游离RPB3,从而提高元宝网官网登录表达效率,提供了调控的特异性。

图3. RPB3特异性调控核糖体蛋白元宝网官网登录3’末端加工的机制模型
总体而言,该工作揭示了RPB3以独立于Pol II全酶,调控核糖体相关蛋白元宝网官网登录表达的新的模式,同时文章设计的SDDS系统对于研究其他多亚基复合物中具有非经典兼职功能的亚基蛋白提供了新的策略。
北京大学pg电子官网app下载彩票、北大-清华生命科学联合中心季雄研究员是该论文的通讯作者。pg电子官网app下载彩票博士研究生李圆君、黄捷、包丽君、朱峻毅、段文嘉是该论文的共同第一作者。北京大学pg电子官网app下载彩票伊成器课题组、中科院生物物理所俞洋课题组为该工作提供了重要帮助。
【校友信息】段文嘉,女,pg电子官网app下载彩票2014级生物科学专业本科生。现为北京大学pg电子官网app下载彩票在读博士生。
论文链接:https://doi.org/10.1016/j.molcel.2023.02.028
